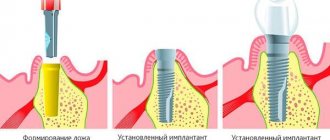
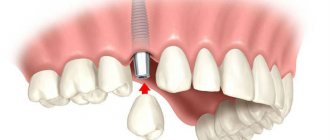
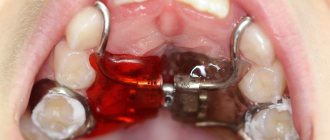
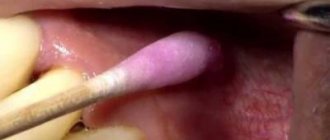
Костная пластика – это наращивание костной ткани, которое зачастую очень необходимо при имплантации зубов. Это связано с тем, что сразу после удаления или утраты зуба костная ткань из-за отсутствия нагрузки постепенно начинает убывать. В итоге ее размера может попросту не хватить для установки имплантата, и понадобится этот недостаток восполнить. Так что если вы потеряли зубы уже давно и только сейчас решились на имплантацию, то пластика кости вам, скорее всего, понадобится.
ВИДЫ КОСТНОЙ ПЛАСТИКИ
Существует несколько основных разновидностей костной пластики, которые применяются в зависимости от зоны будущей имплантации:
- На нижней челюсти по бокам обычно уменьшается ширина и высота альвеолярного отростка, а также значительно уменьшается расстояние от верхней части костной ткани до нижнечелюстного канала. Если костной ткани в этой области не достает, то челюсть может выдвинуться вперед. Пластика тут проводится простая – нужно просто наращивать костную ткань;
- Спереди на верхней и нижней челюсти зачастую формируется острый и тонкий альвеолярный гребень. Пластика в этой зоне немного сложнее, поскольку очень важна эстетичность итогового результата;
- По бокам верхней челюсти пластика необходима из-за того, что при нехватке костной ткани имплантат проникнет в гайморовы пазухи, или в синусы. Здесь пластика осуществляется по особой технологии – синус-лифтингу. Иногда она требуется даже сразу после утраты зуба, если пазухи физиологически слишком крупные.
Симптомы
Перелом альвеолярного отростка верхней челюсти имеет несколько характерных признаков. Самые распространенные симптомы:
- резкая боль,
- невозможность полностью закрыть рот,
- возникновение нарушений прикуса,
- нарушение функций жевания и глотания,
- гематомы,
- вывихи и подвижность одного или нескольких зубов,
- выраженная отечность мягких тканей,
- кровотечение.
При подозрении на перелом альвеолярного отростка необходимо как можно скорее обратиться за медицинской помощью.
Как проходит костная пластика
Как мы отметили выше, методики костной пластики бывают разные, однако в целом она проходит по одной схеме:
- Обезболивание;
- Обеспечения доступа к костной ткани – разрез или прокол слизистых;
- Закладывание выбранного костного материала;
- Ушивание раны до заживления.
Если требовалось восстановить малый объем костной ткани, то есть возможность провести имплантацию одновременной с костной пластикой. Если же атрофия кости была сильной, то понадобится ждать полгода, пока костные блоки полностью не приживутся.
Периостит челюсти — симптомы и лечение
Лечение периостита всегда хирургическое, если отступить от этого правила, то есть серьёзная опасность перетекания ограниченного очага воспаления в более опасную — разлитую форму, которая потребует иной тактики лечения и зачастую госпитализации пациента.
Лечение периостита стандартно и заключается в устранении очага первичного воспаления и эвакуации гноя, т. е. удалении причинного зуба (в случаях неблагоприятного прогноза лечения) и хирургическом вскрытии очага на всю его ширину с последующим дренированием.
Процедуру обычно проводят под местной анестезией, в некоторых случаях показана медикаментозная седация, не исключено и проведение наркоза. Нужно понимать, что введение анестетика в напряжённые экссудатом (скоплением жидкости) ткани — процедура крайне болезненная, поэтому в методике обезболивания перед периостотомией (вскрытием гнойника) есть своя специфика: предпочтительна проводниковая анестезия (вид обезболивания, когда нерв блокируется до участка операции) с последующим локальным обезболиванием, проводимым тонкой иглой поверхностно, без погружения иглы в абсцесс.
Больной зуб необходимо удалить в случае неблагоприятного терапевтического прогноза: наличие больших очагов деструкции кости, некорректное ранее проведённое лечение каналов, повлекшее их перфорацию или закупорку отломком инструмента и т. п. В случаях благоприятного прогноза проводят эндодонтическое лечение, которое подразумевает удаление из каналов распада пульпы, соответствующую механическую и медикаментозную обработку каналов специальным инструментом и мощными антисептиками для устранения в них инфекции с последующей временной пломбировкой препаратами кальция и временной пломбировкой зуба. Очень важен последующий рентгенологический контроль с целью подтверждения эффекта от проведённой терапии каналов: очаг деструкции в кости должен уменьшиться и в дальнейшем исчезнуть.
Для эвакуации гноя производится периостотомия (рассечение слизистой и надкостницы) на всю длину инфильтрата по переходной складке.
Как правило, хирург обнаруживает характерный симптом — отслойку периоста от кости, тогда как в здоровом состоянии периост прочно прикреплён к корковому слою. На этом этапе происходит опорожнение гнойника, либо обнаруживается отсутствие гноя наряду с периостальной реакцией. Хирург тупым инструментом зондирует всю полость абсцесса для выявления изолированных очагов. В случае наличия гноя обычно проводится ирригация (промывание) поднадкостничного пространства антисептиками с последующим введением дренажа (обычно полоски перчаточной резины) в рану для предупреждения слипания её краёв. Рана не ушивается, пациенту назначается перевязка через сутки или двое с целью удаления дренажа [8].
При отсутствии противопоказаний назначается антибактериальная терапия (в большинстве случаев полусинтетические пенициллины) и НПВП (нестероидные противовоспалительные средства). В случае выраженного отёка назначают десенсибилизирующие препараты. Обязательно и назначение анальгетиков либо их непосредственное внутримышечное введение после операции, поскольку в первые часы после лечения, когда заканчивается действие анестетика, проявляется выраженная болевая симптоматика. Имеет смысл и локальное охлаждение льдом области инфильтрата в течение нескольких часов для уменьшения кровотечения и отёка. Время охлаждения необходимо назначать руководствуясь субьективными ощущениями пациента, а не конкретным временным промежуткам.
Практически всегда данное лечение приводит к положительному результату: уже через несколько часов пациент испытывает облегчение, снижение болевых ощущений и отёка. Хотя инфильтрат в виде умеренно болезненного уплотнения будет сохраняться в течение нескольких дней.
Необходим повторный визит на следующий день для подтверждения результатов проведённого лечения и возможного удаления дренажа, если отсутствуют выделения из раны. В дальнейшем пациент наблюдается у врача 3-5 дней, вполне правомерна выдача листа нетрудоспособности на этот период. После исчезновения выраженных симптомов воспаления приступают к продолжению лечения причинного зуба.
В редких случаях, например, при разрезе недостаточной длины либо при выпадении дренажа и слипания краёв раны, лечение может осложниться из-за задержки эвакуации остатков гноя из очага. В этих случаях следует расширить разрез и обеспечить опорожнение введением дренажа.
Материалы для костной пластики
Для наращивания тканей при костной пластике требуется костный материал. Существует четыре основных варианта материалов для костной пластики:
- Аутогенный трансплантат. Такой трансплантат берется из кости самого пациента. Обычно костный блок забирают из челюсти в районе зубов мудрости, из подбородка, либо из другой зоны. Приживаемость таких имплантатов почти стопроцентная, однако требуется забор донорского материала, то есть дополнительная, достаточно тяжелая операция, поэтому такие трансплантаты применяют редко;
- Аллотнасплантат. Такие трансплантаты берут из костного материала другого человека, завещавшего органы для медицинских целей. Костные блоки тщательно отбираются, стерилизуются и перерабатываются так, чтобы в итоге организм воспринимал их как свой собственный костный материал;
- Ксенотрансплантат. Для его изготовления используется кровь крупного рогатого скота, чаще всего коров или быков. Кости тщательно стерилизуются и подготавливаются особым образом так, чтобы организм человека воспринимал их как свою собственную кость. Ксенотрансплантаты приживаются достаточно хорошо;
- Аллопластические трансплантаты, изготовленные полностью из искусственных материалов. Они бывают разными. К примеру, рассасывающиеся трансплантаты не заменяют, а скорее стимулируют костную ткань самого человека, которая в итоге растет быстрее, а сам имплантат потом рассасывается. Существуют и нерассасывающиеся трансплантаты, которые служат решеткой, на которую нарастает кость.
Диагностика
На начальном этапе врач выслушает жалобы пациента, выяснит механизм травмы. Далее специалист переходит к осмотру, позволяющему получить много ценной информации. При тяжелых переломах со смещением диагноз удается поставить уже на этом этапе.
Подвижность отломков при полном переломе можно определить при пальпации. На основании этих данных можно предположить место и направление перелома.
Точная диагностика осуществляется на основе рентгенографического исследования. На снимке четко визуализируется линия перелома, направление смещения отломков. Более подробную информацию позволяет получить компьютерная томография. Эта методика дает возможность сделать снимки послойных срезов поврежденного участка, а также определить состояние мягких тканей и положение отломков относительно других анатомических структур.
При переломе в области альвеолы страдают зубы. Стоматолог должен определить, какие из них можно попытаться сохранить. С этой целью определяется жизнеспособность пульпы с помощью ЭОД. В сомнительных случаях исследование проводится повторно спустя 1-2 недели, пульпа может подвергнуться некрозу или восстановить жизнеспособность. На основании полученного результата определяется дальнейшая тактика.
ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ ПОСЛЕ КОСТНОЙ ПЛАСТИКИ
Костная пластика – это достаточно сложная операция, так что осложнения после нее – не такое уж редкое дело. Любая ошибка хирурга может вызвать:
- Воспаление раны;
- Развитие нагноения;
- Полное отторжение костного блока.
А вот отек мягких тканей после костной пластики – это не осложнение, а вполне обычное явление. Как правило, через три дня отек полностью спадает. Также в зоне пластики могут возникать гематомы, но они тоже безопасны для здоровья человека.
Методы лечения переломов
Лечение переломов альвеолярного отростка верхней челюсти включает несколько этапов:
- купирование боли,
- обработку антисептиком,
- репозицию всех отломков,
- иммобилизацию специальными конструкциями.
Переломы со смещением требуют сложного лечения. При серьезных повреждениях проводят ревизию раны, сглаживают острые края костных отломков и ушивают слизистую. Фрагменты костей возвращают в правильное положение и надежно фиксируют скобами или шинами. Для профилактики осложнений в первые дни после получения травмы назначают антибактериальную терапию, полоскание рта отварами трав.
При своевременном оказании квалифицированной помощи костная мозоль формируется в течение 8 недель. Скорость восстановления зависит от индивидуальных особенностей организма.
Устранение дефекта альвеолярного отростка верхней челюсти при перфорации верхнечелюстного синуса
Перфорация дна верхнечелюстной пазухи — одно из наиболее часто встречающихся в стоматологической практике осложнений, возникающих непосредственно в ходе операции удаления зубов верхней челюсти. Возникшее сообщение полости рта с верхнечелюстным синусом требует от врача принятия срочных мер по закрытию дефекта, так как ороантральное соустье является в будущем воротами для проникновения одонтогенной инфекции из полости рта в полость синуса [2, 3]. Вопросам диагностики, профилактики и лечения перфораций верхнечелюстной пазухи посвящено значительное число работ [2, 5, 7].
Актуальность исследования
При традиционных методах лечения дефект костной ткани не восстанавливается, ушивается только слизистая оболочка, что приводит к нарушению формы альвеолярного отростка, а в 9—30 % случаев — к расхождению краев раны и формированию стойких свищей [7].
Недостаточно полно освещены вопросы костной пластики ороантральных перфораций, направленных на возмещение потери костной ткани с целью дальнейшего рационального протезирования.
В последнее время широко используется направленная регенерация костных структур. В научной литературе освещается ряд клинических методов лечения данной категории больных с применением различных остеопластических материалов [1, 3, 4, 6]. К сожалению, многие из применяемых препаратов имеют отдельные недостатки, что диктует необходимость поиска новых, более совершенных материалов [1, 5, 6].
В настоящее время, учитывая большое число операций по закрытию ороантрального сообщения, актуальным также является поиск метода профилактики воспалительных осложнений. Имеются лишь единичные работы, посвященные изучению эффективности использования препаратов на полимерной основе при лечении больных с перфорациями дна верхнечелюстного синуса.
В литературе, где описывается большое количество методик пластического закрытия ороантральных перфораций, отсутствуют наиболее удобные и приемлемые способы операций с использованием остопластических средств, предназначенных как для врачей амбулаторного звена, так и стационара.
Цель исследования
Повышение эффективности лечения больных с перфорациями верхнечелюстного синуса за счет использования остеопластических материалов при устранении ороантрального сообщения.
Материал и методы
Всего под наблюдением находились 84 пациента обоего пола в возрасте от 19 до 65 лет с перфорацией дна верхнечелюстного синуса без ярко выраженных клинических и рентгенологических признаков синусита, находившихся на амбулаторном лечении в краевой стоматологической поликлинике г. Ставрополя и отделении челюстно-лицевой хирургии 4-й клинической больницы г. Ставрополя с 2008-го по 2012 г.
Чаще всего перфорация верхнечелюстного синуса встречались в возрастной группе от 19 до 40 лет (59,5 % случаев), то есть наиболее активной в социальном отношении, при этом наблюдалось преобладание лиц мужского пола. У 13 % больных перфорация дна верхнечелюстного синуса сопровождалась проникновением инородного тела в синус (корень зуба или пломбировочный материал), у 87 % больных инородные тела в синусе отсутствовали. Ороантральная перфорация возникала чаще при удалении первых моляров (69,1 %), реже — вторых моляров (16,6 %) (табл. № 1).
Таблица № 1. Варианты локализации перфорации верхнечелюстного синуса (n = 84).
Локализация перфорации | Количество больных | % |
| 1-й премоляр | 4 | 4,8 |
| 2-й премоляр | 6 | 7,1 |
| 1-й моляр | 58 | 69,1 |
| 2-й моляр | 14 | 16,6 |
| 3-й моляр | 2 | 2,4 |
В зависимости от тактики оперативного лечения пациенты с перфорациями дна верхнечелюстной пазухи были разделены на 5 групп. Характеристика и численность исследуемых групп представлены в таблице № 2.
Таблица № 2. Распределение больных по методам лечения в зависимости от размера дефекта (n = 84).
Метод лечения | Размер дефекта | |||
I группа< 5 мм | II группа5—7 мм | III группа> 7 мм | ||
| 1 | «Коллост» | 6 | 7 | 6 |
| 2 | «КоллапАн-М» | 5 | 6 | 6 |
| 3 | «Остеопласт» | 5 | 8 | 4 |
| 4 | «Коллост-гель» +«Остеопласт» | 4 | 7 | 5 |
| 5 | «Коллапан-гель» +«Остеопласт» | 3 | 8 | 4 |
Пациентам всех групп заполнение костного дефекта в зоне перфорации осуществляли с использованием остеопластических материалов отдельно или в сочетании. Для клинического изучения был взят остеопластический биокомпозиционный материал отечественного производства «КоллапАн-М» (ООО «Интермедапатит»), представляющий собой комбинацию синтетического гидроксиапатита и коллагена. Дополнительно использовались препараты «Коллост» в виде блоков и крошки, «Коллост-гель» на основе костного коллагена животного происхождения (ЗАО «Биофармхолдинг) и «Остеопласт» (ООО «Лико») на основе костного коллагена и сульфатированных гликозаминогликанов.
Проведенный анализ показал, что все выявленные ороантральные перфорации можно разделить на три группы в зависимости от размера дефекта:
- I группа — 23 пациента с размером дефекта до 5 мм;
- II группа — 36 пациентов с размером дефекта от 5 до 7 мм;
- III группа — 25 пациентов с размером дефекта более 7 мм.
Сроки поступления больных в клинику с момента возникновения ороантрального соустья были различными. Наибольшее количество больных — 41,6 % — поступило в первые сутки с момента удаления зуба. Согласно данным историй болезни пациентов, наиболее часто встречались левосторонние перфорации — 56 %, правосторонние были зарегистрированы у 44 % больных.
При обследовании больных учитывали клинико-анамнестические данные, включающие жалобы, давность образования ороантрального сообщения, его локализацию, размеры, а также результаты дополнительных методов исследования.
Рентгенологическое исследование, помимо стандартных методов, включало компьютерную томографию (КТ), по результатам которой оценивали состояние костной ткани оперированной области в сроки 3, 6, 12 месяцев.
Эндоскопический осмотр проводили с помощью жесткого эндоскопа фирмы Rami (Италия) с углами обзора 0, 30, 70° и диаметром рабочей трубки 4 мм. Указанные характеристики прибора позволили не только ввести рабочую часть трубки через ороантральное сообщение (при размере более 5 мм) в пазуху, но и осмотреть ее стенки. Эндоскопическая картина фиксировалась на видео. Выбор метода пластического закрытия ороантрального дефекта зависел от его размеров (табл. № 4).
Таблица № 4. Методы пластического закрытия ороантральных перфораций в зависимости от их размеров (n = 84).
Метод пластики дефекта | I группаДефект костной ткани < 5 мм | II группаДефект костной ткани 5—7 мм | III группаДефект костной ткани > 7 мм |
| Ушивание мягких тканей под перфорацией | 23 | 31 | 0 |
| Трапециевидный лоскут с преддверия полости рта | 0 | 5 | 25 |
Величина костного дефекта, его локализация и форма определялись по данным компьютерной томографии в различных режимах (рис. 1 а, б).
Рис. 1а. Компьютерная томография в 3D-режиме, перфорация верхнечелюстного синуса, ороантральное соустье. Рис. 1б. Компьютерная томография в 3D-режиме, перфорация верхнечелюстного синуса, ороантральное соустье.
У 64,3 % больных с небольшими и средними размерами перфораций до 7 мм проводили ушивание слизистой оболочки под зоной перфорации. Для этого освежали края раны вокруг ороантрального дефекта со стороны полости рта, поднадкостнично отсепаровывали слизистую оболочку вокруг, делали два послабляющих параллельных разреза, идущих со стороны преддверия рта на небо. При необходимости проводили дополнительный надрез по небной стороне на расстоянии 5 мм кнутри от ороантрального дефекта.
Пластическое закрытие у больных с размером дефекта более 7 мм в 35,7 % случаев выполнено по методу А. Г. Мамонова, Б. В. Кононова (1973) слизисто-надкостничным лоскутом трапециевидной формы, выкроенным с преддверия полости рта. После деэпителизации трапециевидного лоскута отслаивали слизисто-надкостничный лоскут по краю лунки с небной стороны и в образовавшийся карман вводили край трапециевидного лоскута (рис. 2 а, б).
Рис. 2а. Заполнение полости остеопластическим материалом. Рис. 2б. Мобилизация и ушивание слизисто-надкостничного лоскута.
Исследование мукоцилиарного транспорта слизистой оболочки полости носа выполняли на 3, 7, 14-й дни после операции при помощи сахаринового теста. С этой целью использовали крупинки пищевого сахарина фирмы Hergestellt (GMBH, Германия). Одну крупинку сахарина весом 0,3 г помещали на поверхность нижней носовой раковины, отступая 1 см от ее переднего конца. Пациенту предлагали выполнять одно глотательное движение в минуту и замеряли время. При появлении вкусового ощущения сладкого в полости рта отмечали время мукоцилиарного транспорта.
При статистической обработке результатов исследования использовали непараметрические методы: Манна и Уитни, Крускала — Уоллиса и критерий Х² (Гублер Е. Г., Генкин А. Р., 1973). Статистически значимыми считали различия с p <0,05.
Результаты и обсуждение
Анализ сроков эпителизации раневой поверхности показал, что у пациентов 1—3-й групп эпителизация раны составила в среднем 7 суток, у пациентов 4—5-й групп — 5 суток. В 4—5-й группах отмечался более ранний гемостаз, меньшее число рецидивов, отеков, болевых синдромов, ускоренное заживление мягких тканей раневой поверхности по сравнению с 1—3-й группами. Полученные данные были подтверждены в ходе повторных КТ-исследований, проведенных в послеоперационном периоде через 3, 6 и 12 месяцев после пластики ороантрального соустья (табл. № 3).
Таблица № 3. Размеры костного дефекта до и в различные сроки после операции по данным компьютерной томографии (в мм).
Исследуемые группы | Группы | До лечения | Через 3 месяца | Через 6 месяцев | Через 12 месяцев |
| 1 | 2 | 3 | 4 | ||
| «Коллост» | <� 55—7 > 7 | 3,8±0,25,2±0,3 7,1±0,4 | 2,3±0,33,2±0,2*1 5,4±0,3*1 | –*1,22,0±0,2*1 3,1±0,3*1 | –*1,2–*1—3 1,9±0,1 |
| «КоллапАн-М» | <� 55—7 > 7 | 3,7±0,35,4±0,4 7,0±0,5 | 2,1±0,1*13,0±0,2*1 3,5±0,5*1 | –*1,21,4±0,1*1,2 2,1±0,3*1 | –*1,2–*1—3 –*1—3 |
| «Остеопласт» | <� 55—7 > 7 | 3,6±0,25,1±0,3 6,9±0,3 | 2,0±0,1*12,9±0,2*1 3,6±0,3*1 | 1,2±0,08*1,22,0±0,2*1,2 2,8±0,3*1 | –*1—3–*1—3 –*1—3 |
| «Коллост-гель» +«Остеопласт» | <� 55—7 > 7 | 3,9±0,15,4±0,2 7,2±0,5 | –*11,1±0,08*1 2,2±0,1*1 | –*1,2–*1,2 1,3±0,3*1,2 | –*1,2–*1,2 –*1—3 |
| «Коллапан-гель» +«Остеопласт» | <� 55—7 > 7 | 3,5±0,35,1±0,4 7,7±0,3 | –*12,2±0,1*1 3,3±0,2*1 | –*1,21,2±0,08*1,2 1,9±0,2*1,2 | –*1,2–*1—3 –*1—3 |
* 1, 2, 3: отношение результата к исходному значению.
Данные рентгенологических исследований у больных 4—5-й групп подтвердили, что регенерация костной ткани в области дефекта завершалась уже к 3—4-му месяцу. Полное восстановление костной ткани наступало к 6 месяцам наблюдений. У больных 1—3-й групп восстановление костной ткани на ранних сроках проходило гораздо медленнее. Результаты клинического течения послеоперационного периода свидетельствуют о том, что введение в костную полость препаратов «Коллост-гель» + «Остеопласт» и «Коллапан-гель» + «Остеопласт» способствует снижению интенсивности основных клинических признаков (боль, отек, температурная реакция) по сравнению с 1—3-й группами.
Комплексный подход с использованием современных остеопластических биоматериалов в виде блоков, крошки, геля и оптимальных способов костной пластики позволяет добиться выздоровления больных даже в амбулаторных условиях Воспалительные явления слизистой оболочки синуса существенно тормозили транспортную функцию мерцательного эпителия вплоть до полной ее блокады. Динамика восстановления времени мукоцилиарного транспорта слизистой синуса в полость носа зависела от давности перфорации — чем раньше больному проводилось хирургическое вмешательство по устранению ороантрального дефекта, тем быстрее восстанавливались функции слизистой оболочки синуса. В случаях устранения «свежей» перфорации (до 3 суток) слизистая носа и верхнечелюстного синуса практически не была подвержена реактивным послеоперационным явлениям и локальные воспалительные процессы, обусловленные патологическим процессом, быстро купировались.
Таким образом, комплексный подход с использованием современных остеопластических биоматериалов в виде блоков, крошки, геля и оптимальных способов костной пластики позволяет добиться стойкого выздоровления больных даже в амбулаторных условиях.
Разработанный лечебно-диагностический алгоритм дает возможность сократить сроки лечения больных в среднем на 2—3 дня, предотвратить послеоперационные воспалительные осложнения, предупредив тем самым возникновение верхнечелюстного синусита, уменьшить риск рецидива послеоперационного ороантрального сообщения. Разработанная методика устранения ороантрального дефекта позволяет не только подготовить альвеолярный отросток верхней челюсти для дальнейшего протезирования, но и способствует скорейшему восстановлению транспортной функции слизистой оболочки носа и верхнечелюстного синуса.
Выводы
Выбор способа пластического закрытия ороантральных перфораций зависит от величины дефекта костной ткани, размеры которого должны определяться с помощью компьютерной томографии. Использование остеопластических материалов для заполнения ороантрального костного дефекта является эффективным и надежным методом восстановления костной и мягких тканей в области, прилежащей к верхнечелюстному синусу.
ЛИТЕРАТУРА
1. Белозеров М. Н. Оценка остеопластических свойств различных биокомпозиционных материалов для заполнения дефектов челюстей / М. Н. Белозеров // Автореф. дис. канд. мед. наук. — М., 2004. — 23 с. 2. Бочарова И. А. Восстановление костной ткани альвеолярного отростка при перфорации верхнечелюстного синуса в условиях направленной тканевой регенерации / И. А. Бочарова // Автореф. дис. канд. мед. наук. — Воронеж, 2008. — 24 с. 3. Лосев Ф. Ф. Костная пластика с применением мембран: показания к применению, возможные ошибки и нарушения принципа действия направленной тканевой регенерации / Ф. Ф. Лосев, А. В. Жарков // Стоматология. — 2010, № 6. — С. 27—32. 4. Панин А. М. Новое поколение остеопластических материалов (разработка, лабораторно-клиническое обоснование, клиническое внедрение). Автореф. дис. докт. мед. наук. — М., 2004. — 52 с. 5. Иванов С. Ю. Клинические результаты использования различных костнопластических материалов при синус-лифтинге / С. Ю. Иванов, А. Ф. Бизяев, М. В. Ломакин, А. М. Панин // Новое в стоматологии. — 2009, № 5. — С. 51—53. 6. Иванов С. Ю. Разработка биоматериалов для остеопластики на основе коллагена костной ткани / С. Ю. Иванов, А. М. Панин, Д. Н. Володина // Клиническая стоматология. — 2005. — № 4. — С. 21—23. 7. Расмуссон Л. А. Закрытие локальных дефектов альвеолярного отростка // Новое в стоматологии. — 2011, № 5. — С. 40—43.